Os principais conceitos e assuntos questionados nas perguntas de vestibular de química são: Transformações químicas, fórmulas químicas de substâncias comuns, tabela periódica, relações de massa e volume, propriedades dos materiais, química orgânica, entre outros.
Nas latinhas de refrigerantes. o elemento alumínio (número atômico 13) está presente na forma metálica e, na pedra-ume, está presente na forma de cátions trivalentes.
Logo. as cargas elétricas relativas do alumínio nas Iatinhas e na pedra-uma são, respectivamente,
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Considere a reação química entre soluções aquosas de carbonato de sódio (Na2CO3) e cloreto de cálcio (CaCl2), produzindo carbonato de cálcio sólido (CaCO3) e cloreto de sódio (NaCl) em solução aquosa.
Supondo rendimento de 100%, a massa, em gramas, de cloreto de cálcio que deve reagir para produzir 10 g de carbonato de cálcio é, aproximadamente,
Massas molares (g/mol)
C = 12,0; O = 16,0; Na = 23,0; Cl = 35,5 e Ca = 40,0.
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Três das evidências da ocorrência de transformação química são:
Essas três evidências são observadas, conjuntamente, quando
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Em um recipiente termicamente isolado e mantido a pressão constante, são colocados 138g de etanol líquido. A seguir, o etanol é aquecido e sua temperatura T é medida como função da quantidade de calor Q a ele transferida.
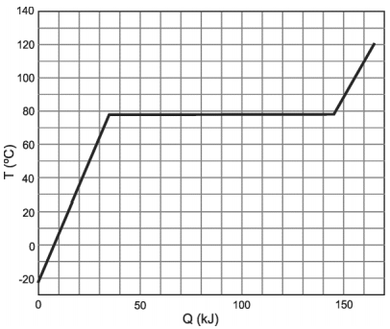
A partir do gráfico de TxQ, apresentado na figura acima, pode-se determinar o calor específico molar para o estado líquido e o calor latente molar de vaporização do etanol como sendo, respectivamente, próximos de
Note e adote
Fórmula do etanol: C2H5OH
Massas molares: C(12 g/mol), H(1 g/mol), O(16 g/mol)
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Louis Pasteur realizou experimentos pioneiros em Microbiologia. Para tornar estéril um meio de cultura, o qual poderia estar contaminado com agentes causadores de doenças, Pasteur mergulhava o recipiente que o continha em um banho de água aquecida à ebulição e à qual adicionava cloreto de sódio.
Com a adição de cloreto de sódio, a temperatura de ebulição da água do banho, com relação à da água pura, era ....... O aquecimento do meio de cultura provocava .......
As lacunas podem ser corretamente preenchidas, respectivamente, por:
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Admite-se que as cenouras sejam originárias da região do atual Afeganistão, tendo sido levadas para outras partes do mundo por viajantes ou invasores. Com base em relatos escritos, pode-se dizer que as cenouras devem ter sido levadas à Europa no século XII e, às Américas, no início do século XVII.
Em escritos anteriores ao século XVI, há referência apenas a cenouras de cor roxa, amarela ou vermelha. É possível que as cenouras de cor laranja sejam originárias dos Países Baixos, e que tenham sido desenvolvidas, inicialmente, à época do Príncipe de Orange (1533-1584).
No Brasil, são comuns apenas as cenouras laranja, cuja cor se deve à presença do pigmento betacaroteno, representado a seguir.
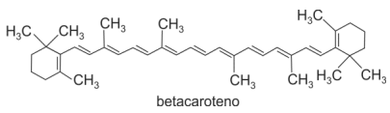
Com base no descrito acima, e considerando corretas as hipóteses ali aventadas, é possível afirmar que as cenouras de coloração laranja
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
O fitoplâncton consiste em um conjunto de organismos microscópicos encontrados em certos ambientes aquáticos. O desenvolvimento desses organismos requer luz e CO2, para o processo de fotossíntese, e requer também nutrientes contendo os elementos nitrogênio e fósforo.
Considere a tabela que mostra dados de pH e de concentrações de nitrato e de oxigênio dissolvidos na água, para amostras coletadas durante o dia, em dois diferentes pontos (A e B) e em duas épocas do ano (maio e novembro), na represa Billings, em São Paulo.
| pH | Concentração de nitrato (mg/L) | Concentração de oxigênio (mg/L) | |
|---|---|---|---|
| Ponto A (novembro) | 9,8 | 0,14 | 6,5 |
| Ponto B (novembro) | 9,1 | 0,15 | 5,8 |
| Ponto A (novembro) | 7,3 | 7,71 | 5,6 |
| Ponto B (novembro) | 7,4 | 3,95 | 5,7 |
Com base nas informações da tabela e em seus próprios conhecimentos sobre o processo de fotossíntese, um pesquisador registrou três conclusões:
É correto o que o pesquisador concluiu em
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Uma moeda antiga de cobre estava recoberta com uma camada de óxido de cobre (II). Para restaurar seu brilho original, a moeda foi aquecida ao mesmo tempo em que se passou sobre ela gás hidrogênio. Nesse processo, formou-se vapor de água e ocorreu a redução completa do cátion metálico.
As massas da moeda, antes e depois do processo descrito, eram, respectivamente, 0,795 g e 0,779 g.
Assim sendo, a porcentagem em massa do óxido de cobre (II) presente na moeda, antes do processo de restauração, era
Dados
Dados: Massas molares (g/mol): H = 1,00; O = 16,0; Cu = 63,5
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Um funcionário de uma empresa ficou encarregado de remover resíduos de diferentes polímeros que estavam aderidos a diversas peças. Após alguma investigação, o funcionário classificou as peças em três grupos, conforme o polímero aderido a cada uma. As fórmulas estruturais de cada um desses polímeros são as seguintes:
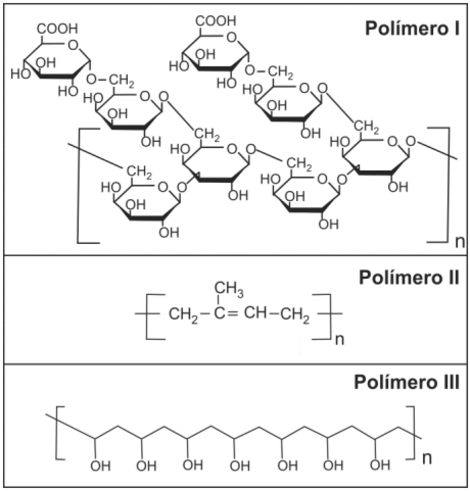
Para remover os resíduos de polímero das peças, o funcionário dispunha de apenas dois solventes: água e n-hexano. O funcionário analisou as fórmulas estruturais dos três polímeros e procurou fazer a correspondência entre cada polímero e o solvente mais adequado para solubilizá-lo. A alternativa que representa corretamente essa correspondência é:
| Polímero I | Polímero II | Polímero III | |
|---|---|---|---|
| A | água | n-hexano | água |
| B | n-hexano | água | n-hexano |
| C | n-hexano | água | água |
| D | água | água | n-hexano |
| E | água | n-hexano | n-hexano |
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
A partir de considerações teóricas, foi feita uma estmativa do poder calorífico (isto é, da quantidade de calor liberada na combustão completa de 1 kg de combustível) de grande número de hidrocarbonetos. Dessa maneira, foi obtido o seguinte gráfico de valores teóricos:
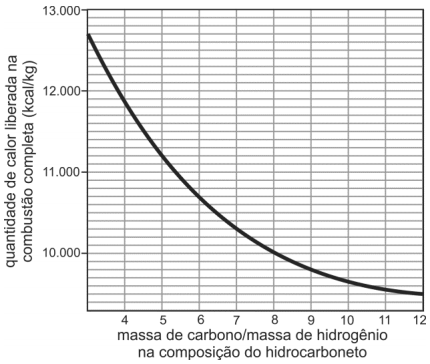
Com base no gráfico, um hidrocarboneto que libera 10.700 kcal/kg em sua combustão completa pode ser representado pela fórmula
Dados
Massas molares (g/mol): C = 12,0 e H = 1,00
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Página 5 de 8