Os principais conceitos e assuntos questionados nas perguntas de vestibular de química são: Transformações químicas, fórmulas químicas de substâncias comuns, tabela periódica, relações de massa e volume, propriedades dos materiais, química orgânica, entre outros.
O uso mais popular do cloreto de sódio é na cozinha, onde é utilizado para acrescentar sabor a uma infinidade de alimentos e também como conservante e material de limpeza. É na indústria química, no entanto, que ele é mais consumido. São inúmeros os processos que fazem uso de produtos do processamento desse sal.
Obtém-se um sal de cozinha do tipo light substituindo-se uma parte do sal comum por cloreto de potássio. Esse produto é indicado para pessoas com problemas de pressão arterial alta. Sabendo-se que a massa molar do sódio é menor que a do potássio, pode-se afirmar que, para uma mesma massa dos dois tipos de sal, no tipo light há
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
O uso mais popular do cloreto de sódio é na cozinha, onde é utilizado para acrescentar sabor a uma infinidade de alimentos e também como conservante e material de limpeza. É na indústria química, no entanto, que ele é mais consumido. São inúmeros os processos que fazem uso de produtos do processamento desse sal.
O uso industrial do cloreto de sódio se dá principalmente no processo de obtenção de alguns importantes produtos de sua eletrólise em meio aquoso. Simplificadamente, esse processo é feito pela passagem de uma corrente elétrica em uma solução aquosa desse sal. Pode-se afirmar que, a partir desse processo, seriam obtidos:
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Na readequação de alguns estádios de futebol, por conta de uma atitude ecológica coerente, milhares de assentos serão produzidos a partir de garrafas PET. Para cada assento serão necessárias cerca de 100 garrafas PET de capacidade de 600 mL e massa de 18 g cada uma. Pode-se afirmar que a redução de volume do material reaproveitado para a fabricação dos assentos será, aproximadamente, igual a
Dados
Densidade do PET = 1,3 g cm-3 . Considere que no reaproveitamento do PET não ocorre perda de massa, e que o volume externo da garrafa é de 600 mL.
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
(Texto para responder às questões de números de 22 a 24)
Os compostos orgânicos mencionados apresentam, respectivamente, as fórmulas estruturais:
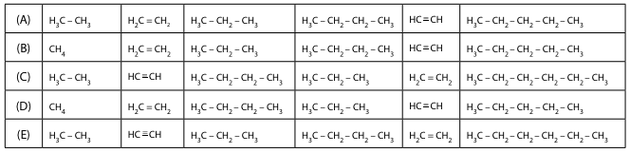
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
(Texto para responder às questões de números de 22 a 24)
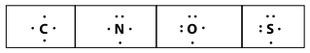 Estrutura de Lewis
Estrutura de LewisEntre os gases mencionados na tabela, o gás poluente que contribui para a acidez da chuva e apresenta geometria linear é
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Leia o texto para responder às questões de números de 22 a 24.
Em 2012, o inverno foi uma estação muito seca, em que a umidade relativa do ar esteve várias vezes abaixo do índice recomendado pela OMS, Organização Mundial da Saúde. Por isso, recomendou-se que as práticas esportivas fossem realizadas pela manhã e suspensas no período da tarde, quando a situação era mais grave. Entre outros problemas, houve também o acúmulo de poluentes atmosféricos, como observado na tabela a seguir.
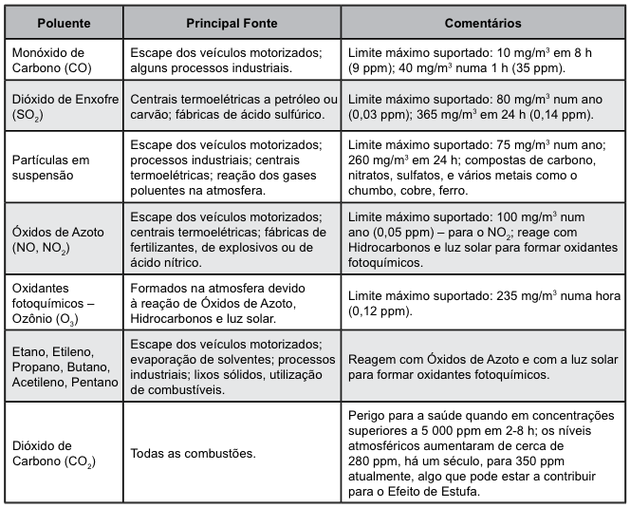
A concentração de monóxido de carbono no limite máximo suportado em uma hora, em mol/m3, é aproximadamente
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
A incorporação de saberes e de tecnologias populares como, por exemplo, a obtenção do sabão de cinzas, a partir de uma mistura de lixívia de madeira queimada com grandes quantidades de gordura animal sob aquecimento, demonstra que já se sabia como controlar uma reação química, cuja finalidade, neste caso, era produzir sabão.
De acordo com o conhecimento químico, o sabão de cinzas se forma mediante a ocorrência de reações químicas entre a potassa, que é obtida das cinzas, e os ácidos graxos presentes na gordura animal.
(www.if.ufrgs.br/ienci/artigos/Artigo_ID241/v15_n2_a2010.pdf Acesso em 21.09.2012. Adaptado)
A palavra potassa é usada em geral para indicar o carbonato de potássio (K2CO3), que, em meio aquoso, sofre hidrólise. A produção do sabão é possível porque a hidrólise da potassa leva à formação de um meio fortemente
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
A produção de alimentos para a população mundial necessita de quantidades de fertilizantes em grande escala, sendo que muito deles se podem obter a partir do amoníaco.
Fritz Haber (1868-1934), na procura de soluções para a otimização do processo, descobre o efeito do ferro como catalisador, baixando a energia de ativação da reação.
Carl Bosch (1874-1940), engenheiro químico, colega de Haber, trabalhando nos limites da tecnologia no início do século XX, desenha o processo industrial catalítico de altas pressões e altas temperaturas, ainda hoje utilizado como único meio de produção de amoníaco e conhecido por processo de Haber-Bosch.
Controlar as condições que afetam os diferentes equilíbrios que constituem o processo de formação destes e de outros produtos, otimizando a sua rentabilidade, é um dos objetivos da Ciência/Química e da Tecnologia para o desenvolvimento da sociedade.
(nautilus.fis.uc.pt/spf/DTE/pdfs/fisica_quimica_a_11_homol.pdf Acesso em 28.09.2012)
Considere a reação de formação da amônia e o gráfico, que mostra a influência conjunta da pressão e da temperatura no seu rendimento.
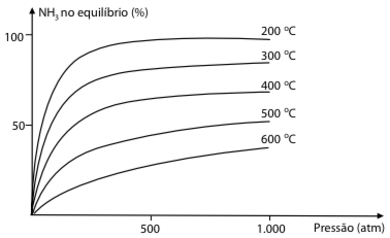
A análise do gráfico permite concluir, corretamente, que
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
No modelo da foto a seguir, os átomos de carbono estão representados por esferas pretas e os de hidrogênio, por esferas brancas. As hastes representam ligações químicas covalentes, sendo que cada haste corresponde ao compartilhamento de um par de elétrons.

O modelo em questão está, portanto, representando a molécula de
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Para que uma transformação química esteja em estado de equilíbrio dinâmico, é necessário, entre outros fatores, que
Clique aqui e faça uma pergunta na sessão de comentários desta questão.
Página 4 de 8